Technika
cieplna – ćwiczenie laboratoryjne nr 7 (21.04.07)
BADANIE PARAMETRÓW
PRZEMIANY ADIABATYCZNEJ
4Inst-ADplusRys-27
- Matematyczno-fizyczny opis przemiany adiabatycznej.
Adiabatą nazywamy przemianę, w której warunkiem koniecznym jest
brak wymiany ciepła z otoczeniem. Jest to możliwe wówczas, gdy podczas tej
przemiany ani ciepła nie doprowadzamy, ani też go nie odprowadzamy. Ponieważ q = const (lub Q = const) wartość różniczkowego
ciepła przemiany adiabatycznej wyniesie:
![]()
Jeśli przemiana ta jest odwracalna, spełnia ona również warunek braku przyrostu entropii
![]()
Całkowanie równania (1) pozwala stwierdzić niezmienność
entropii (![]() ). Dlatego też odwracalna przemiana adiabatyczna bywa
nazywana przemianą izentropową lub ściślej przemianą adiabatyczno-izentropową. Przebieg
przemiany przedstawiony jest na rys. 1 w układzie p – υ, zwanym układem pracy, a na rys. 2 w
układzie ciepła (T – s).
). Dlatego też odwracalna przemiana adiabatyczna bywa
nazywana przemianą izentropową lub ściślej przemianą adiabatyczno-izentropową. Przebieg
przemiany przedstawiony jest na rys. 1 w układzie p – υ, zwanym układem pracy, a na rys. 2 w
układzie ciepła (T – s).


υ [m3/kg]

Rys. 1. Przemiana adiabatyczna na wykresie p – υ (tzw. układ pracy).

Rys. 2. Adiabata na wykresie T – s (tzw. układ ciepła).
Podstawą analitycznego ujęcia przebiegu przemiany adiabatyczno-izentropowej jest pierwsza zasada termodynamiki sformułowana w 1842 r. przez J. R. Mayera ( uściślona 5 lat później przez H. de Helmholtza). Poniżej wyprowadzimy pierwszy wariant równania adiabaty przy założeniu, że opis przemiany wyrazimy za pomocą współrzędnych p – υ .
Z równania I zasady termodynamiki (tzw, pierwsza postać) i warunku cieplnego przemiany (dq = 0) wynika:
![]() (1)
(1)
gdzie:
|
.dq |
- |
elementarne ciepło przemiany [J/kg], du - różniczkowy przyrost energii wewnętrznej ( du = cv dT) , [J/kg], |
dlz = p dυ - elementarna praca zewnętrzna [ J/ kg],
p - ciśnienie [ Pa = N/ m2],
υ - objętość właściwa równa υ = V/m , ![]() ,
,
V, m - objętość [m3] i masa gazu [kg]
Ponieważ du = ![]() , więc
, więc
![]() .
.
Równanie stanu gazu doskonałego (wariant chemiczny wykorzystuje uniwersalną stałą gazową a wersja techniczna - indywidualną stała gazową Ri = R) ma postać:
.p υ = R T [ J/ kg ],
R – indywidualna stała gazowa [ J/(kg K) ],
T – temperatura bezwzględna [ K ].
Powyższe równanie pozwala – po zróżniczkowaniu - wyznaczyć:
dT = d (p υ)/R, czyli
![]() (2)
(2)
Indywidualna stała gazowa [ J/( kg K)] może być ujęta tzw. wzorem Mayera:
![]() , więc
, więc
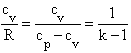 (3)
(3)
Stosunek
![]() jest tzw.
wykładnikiem przemiany adiabatycznej ( w równaniu końcowym wystąpi jako wykładnik
potęgi w członie z objętością właściwą).
jest tzw.
wykładnikiem przemiany adiabatycznej ( w równaniu końcowym wystąpi jako wykładnik
potęgi w członie z objętością właściwą).
Podstawiając wyrażenie (3) do równania (2) otrzymuje się:
![]() .
.
Mnożąc obie strony równania przez (k-1) uzyskujemy po redukcji wyrazów podobnych :
![]()
Dzieląc obie strony równania przez iloczyn p.v otrzymamy równanie różniczkowe adiabaty:
![]()
Jego całkowanie prowadzi do wyniku
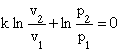 ,
,
i następnie:
p1 .υ1k = p2 .υ2 k , (4)
co stanowi równanie adiabaty-izentropy w układzie p – υ ( tzw. układ pracy).
Krzywe ilustrujące przemianę adiabatyczną przedstawione zostały na rys. 1, 2.
Równanie adiabaty możemy przedstawić również w postaciach odmiennych od równania (3), uwzględniających zmianę trzeciego czynnika czyli temperatury. W tym celu zależność (3) zapiszemy w postaci ogólnej, wykorzystując równanie stanu:
p .υ k 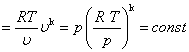 (5)
(5)
Z ogólnej postaci równania adiabaty (4) można uzyskać następujące zależności:
a) zmienność objętości właściwej i temperatury:
T υ k-1 = const,
lub ![]() (6)
(6)
b) zmienność ciśnienia i temperatury:
T k p1 – k =
const, lub ![]()
Równanie (6) może być podstawą do przewidywania kierunku zmiany temperatury przy sprężaniu (spadek objętości właściwej i wzrost temperatury) i rozprężaniu gazu (odwrotnie).
Pracę zewnętrzną oblicza się z pierwszej zasady termodynamiki, czyli:
![]()
Skąd wynika:
![]()
a po scałkowaniu otrzymujemy:
lz = u1 – u2 (7)
A więc praca zewnętrzna zostaje wykonana kosztem spadku energii wewnętrznej. Wyrażenie (6) można jeszcze przekształcić do postaci:
![]() .
.
Ponieważ ![]() = R oraz
= R oraz ![]() , więc
, więc ![]() , i następnie
, i następnie
![]() (8)
(8)
Praca techniczna występuje w drugiej postaci I zasady termodynamiki, czyli można ją obliczyć analogicznie do pracy zewnętrznej. Ponieważ :
![]()
czyli
![]()
oraz
l t = i1 – i2
Jak z powyższego wynika warunkiem
wykonania pracy technicznej jest spadek entalpii właściwej [ J/ kg], czyli jest
ona wykonana kosztem tego spadku.
Między pracą techniczną i zewnętrzną zachodzi następująca zależność:
![]() ,
,
.czyli: lt = k lz
Korzystając z równania (7) otrzymujemy:
![]() (9)
(9)
- Wybrane metody oznaczania wykładnika
adiabaty
W dalszych rozważaniach rozpatrzymy dwie metody oznaczenia wykładnika adiabaty:
a) metoda Clementa-Desormesa,
b) metoda Lummera-Pringsheima.
Pierwsza metoda wymaga prowadzenia pomiaru przy stosowaniu małych nadciśnień gazu, podczas gdy w drugiej ograniczenie to nie występuje. Obie metody wykorzystują matematyczny opis przemiany adiabatycznej w odniesieniu do zmienności ciśnienia, z czego wynika, że podstawowym przyrządem pomiarowym jest manometr cieczowy.
Opisane niżej doświadczenie spełnia założenie przebiegu przemiany przy małych ciśnieniach ( nadciśnieniach) czyli szukana wartość wykładnika adiabaty może być uzyskana za pomocą procedur obliczeniowych opisujących obie z wymienionych metod.
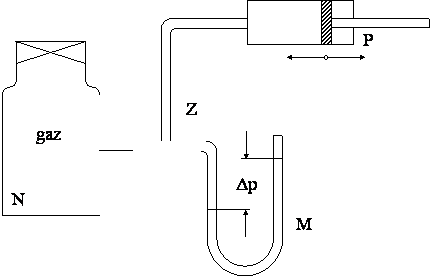
Schemat układu pomiarowego przedstawiono na rys. 3.
![]()
![]()
![]()
Rys. 3. Schemat układu pomiarowego ( N – naczynie z badanym gazem,
M – mikromanometr cieczowy, Z – zawór szklany obrotowy, P – pompka sportowa,
Δp - mierzone ciśnienie , mm H2O ).
Badany gaz ( np. powietrze) znajduje się w zamkniętym naczyniu
laboratoryjnym. Pierwszy etap pomiaru polega na wtłoczeniu do naczynia
niewielkiej ilości tego samego gazu za pomocą pompki sportowej, co powoduje (obserwowany)
wzrost jego ciśnienia np. o ok. ![]() ( jest to niewielka
wartość nadciśnienia, łatwa do pomiaru dowolnym manometrem cieczowym).
Sprężanie gazu powoduje wzrost jego temperatury, przy czym z uwagi na krótki
czas jego trwania możemy go traktować jako proces adiabatyczny (założenie to
nie ma związku a dokładnością dalszych obliczeń) .
( jest to niewielka
wartość nadciśnienia, łatwa do pomiaru dowolnym manometrem cieczowym).
Sprężanie gazu powoduje wzrost jego temperatury, przy czym z uwagi na krótki
czas jego trwania możemy go traktować jako proces adiabatyczny (założenie to
nie ma związku a dokładnością dalszych obliczeń) .
Kolejnym etapem, zachodzącym samoistnie, jest izochoryczne oziębianie gazu, zakończone po uzyskaniu zrównania jego temperatury z otoczeniem. Ten etap ( drugi) kończy wstępną część eksperymentu, przy czym jej przebieg ma znikomy wpływ na dokładność części obliczeniowej.
Dowodem zakończenia tej przemiany jest stabilizacja wskazań manometru.
Badany gaz posiada w tym momencie pewne nadciśnienie. Otwarcie zaworu Z ( rys. 3), powoduje wypuszczenie z naczynia pewnej ilości gazu i jego rozprężenie. Zawór zamykamy w momencie zrównania ciśnienia gazu w naczyniu z wartością ciśnienia otoczenia. Proces ten trwa ułamek sekundy, co pozwala założyć, że zachodzi on w sposób adiabatyczny. Adiabatycznemu rozprężaniu towarzyszy oziębienie badanego gazu poniżej temperatury otoczenia .
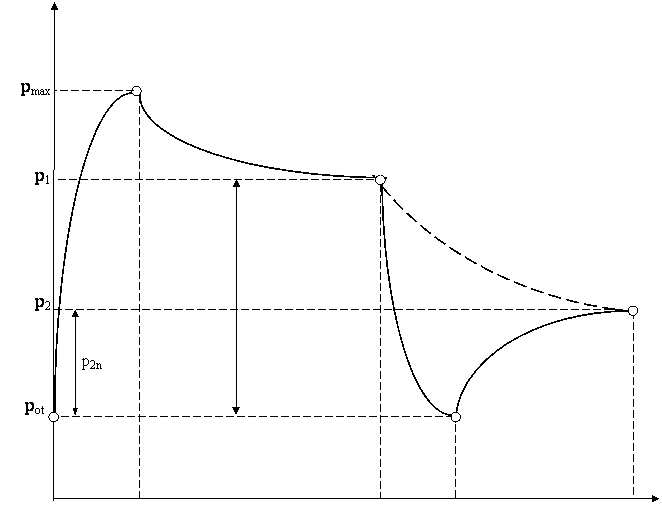
p [mm H2O]
B (pmax , T1)
C( p1, Tot )
![]() p1n E
(p2, Tot)
p1n E
(p2, Tot)
![]() D (pot , T2)
D (pot , T2)
A(pot ,Tot)
τB τC τD τE [s]
Rys. 4. Krzywa zmiany ciśnienia badanego gazu jako
podstawa podziału
procesu pomiarowego na 4 etapy (AB -
adiabata, BC – izochora,
CD – adiabata,
DE – izochora, CE – teoretyczna
izoterma).
W związku z różnicą temperatur gazu w naczyniu i otoczeniu następuje samoistne izochoryczne podgrzewanie
gazu do momentu wyrównania temperatur, czemu towarzyszy wzrost ciśnienia (p/T = const). Wartość tego
wzrostu ![]() (rys. 4) jest zawsze mniejsza w porównaniu z ciśnieniem początkowym etapu adiabatycznego (
(rys. 4) jest zawsze mniejsza w porównaniu z ciśnieniem początkowym etapu adiabatycznego (![]() ), co można wyjaśnić zmniejszeniem masy gazu po otwarciu zaworu w 3.etapie
eksperymentu. Przebieg obu procesów adiabatycznych dowodzi, że adiabatyczne sprężanie
(linia AB) pociąga za sobą wzrost temperatury gazu, podczas gdy rozprężaniu
(CD) towarzyszy spadek temperatury, przy wzroście objętości właściwej zgodnie z
równaniem (6).
), co można wyjaśnić zmniejszeniem masy gazu po otwarciu zaworu w 3.etapie
eksperymentu. Przebieg obu procesów adiabatycznych dowodzi, że adiabatyczne sprężanie
(linia AB) pociąga za sobą wzrost temperatury gazu, podczas gdy rozprężaniu
(CD) towarzyszy spadek temperatury, przy wzroście objętości właściwej zgodnie z
równaniem (6).
Zauważając, że dwa ostatnie etapy eksperymentu ( adiabata połączona z izochorą) odpowiadają przemianie izotermicznej a etap przedostatni – adiabatycznej, należy opisać te procesy z punktu widzenia mierzonych zmian ciśnienia ( nadciśnienia). W obliczeniach tych niezbędna jest znajomość podstawowej zależności definicyjnej nadciśnienia:
pn = p - pot
gdzie: pn - nadciśnienie mierzone manometrem (cieczowym z rurką pochyłą) ,
p - ciśnienie bezwzględne,
pot - ciśnienie barometryczne.
Podstawowe zależności opisujące ideę obu metod zostaną opisane poniżej.
3. Teoretyczne podstawy obliczania ![]() metodą Clementa.
metodą Clementa.
Do dalszych rozważań niezbędne jest wyrażenie związków pomiędzy ciśnieniem i objętością gazu w trakcie procesów adiabatycznego i izotermicznego.
Dla procesu adiabatycznego skorzystamy z następujących zależności:
![]() ;
;
![]() ;
; ![]() ;
;
![]() (10)
(10)
Równanie izotermy możemy uzyskać jako szczególny przypadek adiabaty dla k = 1, czyli dla przemiany izotermicznej zachodzi związek :
![]() (11)
(11)
Wzory (1), (2) w odniesieniu do małej zmiany objętości właściwej ![]() i ciśnienia Δp można
zapisać następująco:
i ciśnienia Δp można
zapisać następująco:
a) dla adiabaty:
![]() (12)
(12)
b) dla izotermy:
![]() (13)
(13)
Ponieważ ![]() więc:
więc:
![]()
po podzieleniu stronami równań (12) i (13) otrzymamy :
![]()
![]()
gdzie:
p1 , p2 - ciśnienia bezwzględne dla punktów pomiarowych 1, 2,
![]() p 1n = p1 – pot - nadciśnienie
dla punktu 1
p 1n = p1 – pot - nadciśnienie
dla punktu 1
4.
Metoda Lummera - Pringsheima
W szczególnym, najprostszym przypadku przebieg badania może być analogiczny do doświadczenia Clementa-Desormesa. Postać zależności opisującej szukany wykładnik k, wynika z następujących przekształceń równania adiabaty:
![]() lub
lub ![]()
Po zlogarytmowaniu mamy:
![]() (14)
(14)
Z równania stanu gazu doskonałego
![]() obliczymy
obliczymy
![]() (15)
(15)
Połączenie zależności (14) i (15) pozwala ująć szukany współczynnik k wzorem:
![]() (16)
(16)
Zgodnie z przebiegiem termodynamicznych etapów doświadczenia [ p = f() - rys. 4] punkty temperaturowe początku (indeks 1) i końca (indeks 2) przemiany adiabatycznej odpowiadają temperaturze otoczenia T1 = Tot (mierzona temperatura powietrza w sali laboratoryjnej) i nieznanej temperaturze końca tej przemiany T2 = Tad. Zależność (16) zapiszemy więc w postaci:
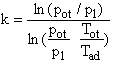 (17)
(17)
Zależność (17) wyraża metodą Lummera-Pringsheima.
Nieznana temperatura końca etapu adiabaty Tad jest temperaturą początku przemiany izochorycznej (etap IV) zakończonej w momencie uzyskania temperatury otoczenia. Początek izochory odpowiada ciśnieniu otoczenia pot a wskutek pobierania ciepła z otoczenia rośnie ono do wartości p2 ( mierzone manometrem jako p2n ). Tak więc równanie izochory ( p/T = const) pozwala na zastąpienie wartości temperatur za pomocą ciśnień:
![]()
Podstawiając wartość Tot / Tad do (17) otrzymamy wzór końcowy w postaci:
 (18)
(18)
5. Termodynamiczne
etapy zastosowanej metody doświadczalnej
Kolejność czynności pomiarowych przy oznaczaniu wykładnika adiabaty k ( ![]() ) przedstawić można w
postaci następujących przemian termodynamicznych:
) przedstawić można w
postaci następujących przemian termodynamicznych:
1) adiabatyczne
sprężenie próbki gazu od ![]() poprzez wtłoczenie do
naczynia niewielkiej ilości gazu za pomocą pompki sportowej ( wzrost ciśnienia
i temperatury – rys. 4);
poprzez wtłoczenie do
naczynia niewielkiej ilości gazu za pomocą pompki sportowej ( wzrost ciśnienia
i temperatury – rys. 4);
2) samoistne, izochoryczne rozprężanie i stygnięcie gazu w wyniku odprowadzania ciepła do otoczenia, zanikające w momencie wyrównania temperatury gazu i otoczenia,
3) adiabatyczne rozprężanie i stygnięcie gazu jako skutek celowego, krótkotrwałego otwarcia zaworu oddzielającego (wcześniej) przestrzeń wewnątrz naczynia od otoczenia ;
4) samoistne, izochoryczne sprężanie gazu - przy asymptotycznym przebiegu wzrostu ciśnienia – związane z pobieraniem ciepła od otoczenia; przemiana kończy się w momencie osiągnięcia termodynamicznej równowagi (wyrównanie temperatury gazu i otoczenia).
6. Przykłady
obliczeń dla obu metod badań
Podczas badań uzyskano następujące nadciśnienia gazu (powietrza) :
![]() =
= ![]() .
.
Wg metody Clementa (dla małych nadciśnień)
![]()
![]()
Zgodnie z metodą Lummera (![]() ) :
) :
![]()
![]()
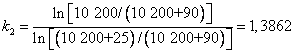
Z
porównania wartości ![]() wynika bardzo dobra
zgodność obu metod dla małych nadciśnień używanych w doświadczeniu. Ponieważ
wzór ścisły dotyczy wartości
wynika bardzo dobra
zgodność obu metod dla małych nadciśnień używanych w doświadczeniu. Ponieważ
wzór ścisły dotyczy wartości ![]() więc błąd względny
wynosi :
więc błąd względny
wynosi :
![]()
Dla małych wartości ![]() 1 mamy
1 mamy
![]()
oraz
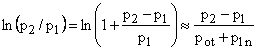
Wtedy uproszczony wzór ma postać:
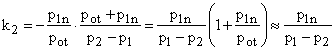 .
.
Matematyczna postać powyższej zależności wyjaśnia równoważność obu metod oznaczania wartości wykładnika adiabaty k przy zastosowaniu metody małych ciśnień.
Arkusz obliczeniowy znajduje się na stronie 11 (ostatniej) 17.04.2007
Literatura:
1. B. Staniszewski: Termodynamika. PWN, 1986.
2. S. Wilk :Termodynamika techniczna, Wyd. Szk. i Pedag. W-wa 1989.
3. S. Wiśniewski: Termodynamika Techniczna, WNT, W-wa 1987.
4. Sz. Szczeniowski: Fizyka doświadczalna. Cz. II. Ciepło i fizyka drobinowa. PWN,
W-wa, 1964.
5. F. Kohlrausch: Fizyka laboratoryjna. PWN, W-wa 1959.
|
Imię |
Nazwisko |
Data |
Rok II.
Grupa |
|
|
|
.04.2007 |
|
Sprawozdanie z ćwiczenia laboratoryjnego nr 7
|
Z7 = |
„Badanie
parametrów przemiany adiabatycznej na przykładzie powietrza”
1. Dane ogólne dla badanego gazu (powietrza wilgotnego *):
![]()
![]() 2. Obliczenie wykładnika k metodą Clementa
(metoda małych ciśnień)
2. Obliczenie wykładnika k metodą Clementa
(metoda małych ciśnień)
a)
obliczenie 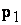 i
i 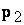 (należy dopasować
jednostki składników równania )
(należy dopasować
jednostki składników równania )
![]()
![]()
b) obliczenie k
![]()
![]()
3. Obliczenie wykładnika k metodą Lummera (dowolne ciśnienie)
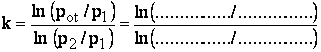 ;
; ![]() (3 miejsca znacz.np.
1,34)
(3 miejsca znacz.np.
1,34)
4. Określenie temperatury końca przemiany adiabatycznej (etap III) jako początku izochorycznego sprężania gazu przy pobieraniu ciepła z otoczenia (IV etap eksperymentu )
![]() ;
; 
5. Obliczenie ciepła właściwego cv.pow i przyrostu energii wewnętrznej
![]() ( równanie Mayera )
( równanie Mayera )
![]()
6. Obliczenie pracy zewnętrznej (podaj wzór !)
l z = ……………………… [ J/ kg]
7. Obliczenie pracy technicznej i zmiany entalpii (wzór !)
![]() ;
; ![]()
8. Teoretyczna wartość wykładnika adiabaty dla powietrza
![]() ……….
……….
9. Obliczenie objętości właściwych dla badanej adiabaty ( na odwrocie )
10. Współczynnik weryfikacyjny ![]()
Jeżeli Z7 nie mieści się w granicach 0.96 ÷ 1.04, to obliczenia należy powtórzyć. Na odwrocie: wnioski, wykres p= f ( τ ), wykres adiabaty (po obliczeniu objętości właściwych υ1 i υ2 ).
Liczba osób posiadających takie same wnioski lub/i wyniki obliczeń wynosi : ……
* uwaga:
indeks ‘pow’ oznacza powietrze